Автор: Вероника Бойченко, студентка 2 курса магистратуры кафедры биохимии МГУ им. М.В. Ломоносова, преподавательница кафедры биологии АПО.
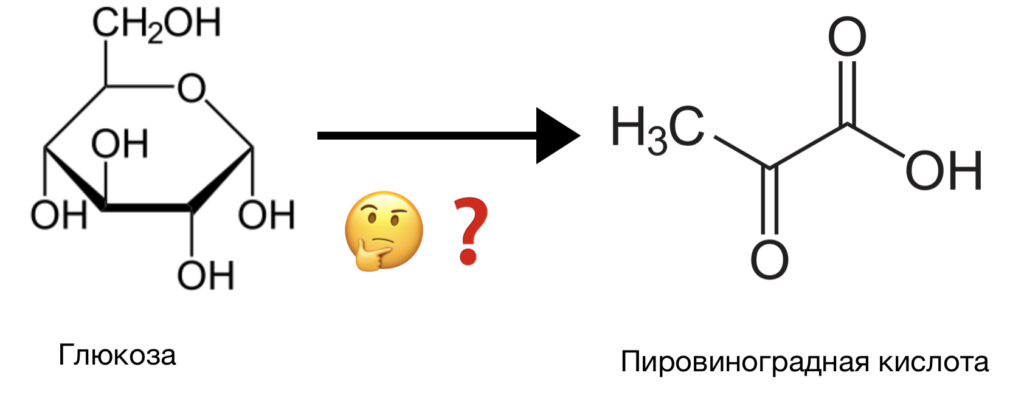
Как вам, вероятно, известно, гликолиз — это процесс расщепления глюкозы до пирувата, но, если мы поместим раствор глюкозы в пробирку, превращения в пируват не произойдёт (рис. 1). И дело здесь даже не в отсутствии физиологических условий (37 градусов Цельсия, нейтральный рН и давление 1 атмосфера), а в отсутствии ферментов — биологических катализаторов, которые будут помогать осуществлять все перегруппировки молекул. Напомним также, что катализатор — это вещество, ускоряющее химическую реакцию.
Раньше существовало мнение, что ферментами могут быть только белки, но в настоящее время показано, что и РНК могут катализировать реакции. Такие соединения получили название рибозимы (сокращение от «рибонуклеиновая кислота» и «энзим»). Они участвуют в процессах синтеза белка на рибосоме и в сплайсинге. Существование рибозимов является одним из свидетельств в пользу гипотезы РНК-мира (рис. 2).

Функции ферментов
Термины «фермент» и «энзим» являются синонимами. Раздел биохимии, который их изучает, называется энзимология. Ниже представлен один из важнейших графиков в энзимологии, схематически объясняющий, как ферменты и другие катализаторы выполняют свою функцию и меняют химические реакции (рис. 3).
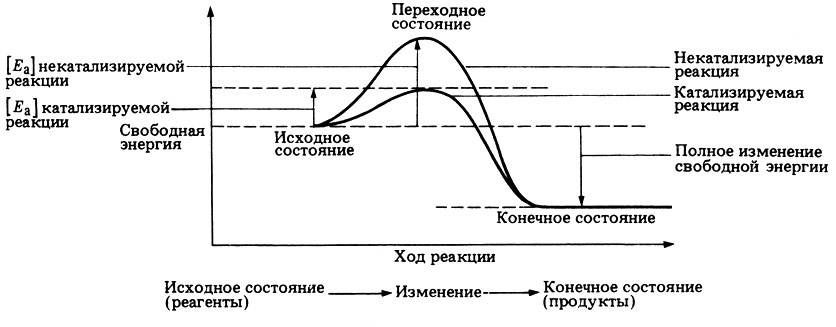
По оси х на данном графике отложен ход реакции, то есть показано, как вещество в исходном состоянии (реагент) приобретает своё конечное состояние (продукт), проходя через переходные состояния (к слову, их может быть несколько, но для простоты мы объединяем все переходные состояния в одно). По оси y отложена свободная энергия — параметр, показывающий изменение энергии в ходе химической реакции. Обычно свободная энергия реагентов выше, чем свободная энергия продуктов, однако молекулам для превращения из одного в другое сначала необходимо приобрести форму переходного состояния с высокой энергией и преодолеть энергетический барьер — разницу между энергиями реагента и переходного состояния. На графике это изображено в виде «холма», на который необходимо «забраться», чтобы дальнейшее превращение в продукт стало возможным. Энергетический барьер также можно называть энергией активации реакции. Далеко не все молекулы во всех реакциях способны самостоятельно преодолеть энергетический барьер: это вероятностный процесс, и чем выше барьер, тем меньше вероятность. Именно тут на помощь приходят катализаторы. Они взаимодействуют с молекулой и изменяют необходимое переходное состояние так, что снижается и энергия активации реакции. Следовательно, вероятность превращения реагента в продукт увеличивается: больше молекул за единицу времени преодолевают новый энергетический барьер.
Подавляющее большинство биохимических реакций обратимы, то есть идёт как превращение субстрата в продукт, так и продукта в субстрат. Таким образом, если катализатор снижает энергию активации реакции, он одинаково ускоряет как прямую реакцию, так и обратную и не смещает химическое равновесие. Также важно, что после образования переходного состояния «субстрат + катализатор» катализатор отделяется и возвращается в своё исходное неизмененное состояние.
Таким образом, катализаторы:
- Снижают энергию активации реакции — энергию, которую нужно дать системе, чтобы реакция запустилась и преодолела свой энергетический барьер
- Не влияют на равновесие реакции и одинаково ускоряют как прямую, так и обратную реакцию
- Остаются неизменными в ходе реакции
Ферменты отличаются от других катализаторов следующими параметрами:
- Высокая эффективность. Существует термин «число оборотов» — число молекул субстрата, претерпевающих превращение в единицу времени в расчете на одну молекулу фермента. Для многих ферментов оно может достигать сотен тысяч за секунду (например, карбоангидраза — 6×10 5 с −1)
- Крайне высокая специфичность: каждый фермент катализирует одну определённую реакцию в организме, в отличие от катализаторов в неорганической химии, каждый из которых может катализировать разнообразные реакции
- Возможность функционирования в физиологических условиях (сравнительно низкие температуры, низкое давление, постоянный близкий к нейтральному рН). Для катализаторов из промышленности чаще всего нужны высокие температуры (например, 500 градусов Цельсия) и высокие значения давления (например, 10 атмосфер)
- Тонкая регуляция активности: большинство ферментов, помимо места связывания самого субстрата — активного центра, — также имеют места связывания для других соединений, которые будут изменять структуру фермента и подстраивать его активность — аллостерические центры.
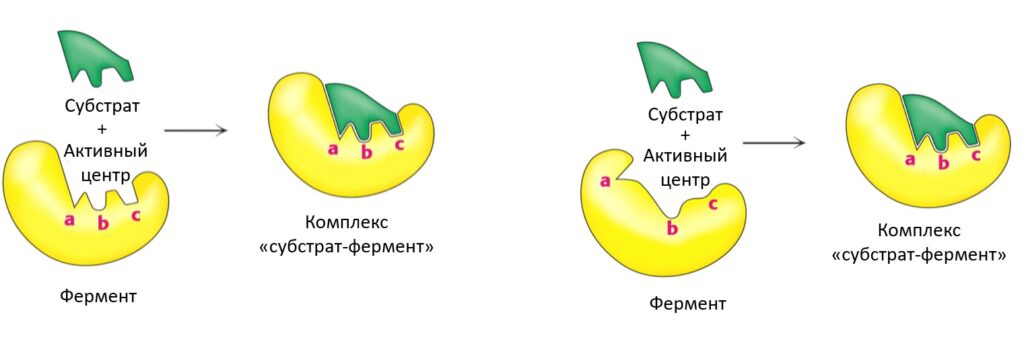
Существует 2 модели взаимодействия фермента с субстратами: модель однозначного соответствия «ключ-замок» и модель индуцированного соответствия «рука-перчатка». В прошлом веке долгое время считалось, что фермент — неизменяемая структура и перестройки при его взаимодействии с субстратом невозможны, однако сегодня модель «рука-перчатка» признана наиболее соответствующей действительности (рис. 4).
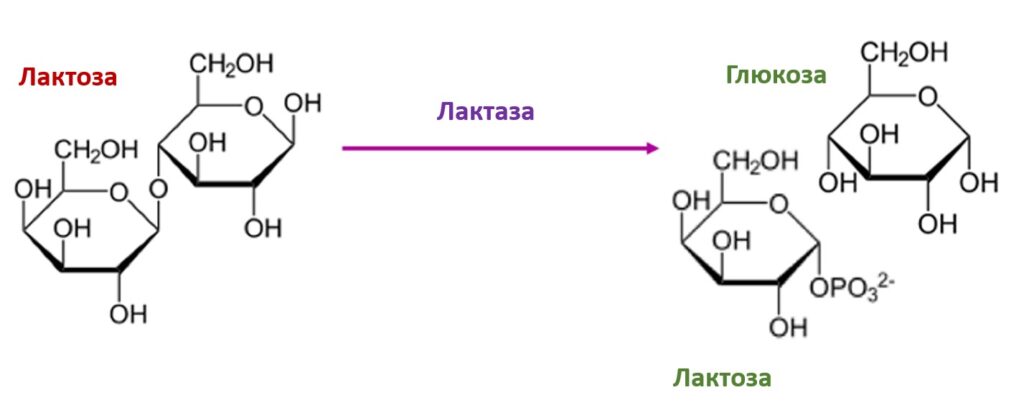
Обычно ферменты называют по типу катализируемой реакции, добавляя суффикс ‑аза к названию субстрата. Например, лактаза — фермент, участвующий в превращении лактозы (рис. 5). Многие ферменты имеют исторически сложившиеся тривиальные названия, не связанные с названиями их субстратов, например пепсин и трипсин. Из-за этих и других затруднений, а также вследствие всё возрастающего числа вновь открываемых ферментов было принято международное соглашение о создании систематической номенклатуры и классификации ферментов (КФ).
Классификация ферментов
Классификация ферментов (КФ, EC — Enzyme Commission code) была предложена Международным союзом биохимии и молекулярной биологии и осуществляется по типу катализируемой реакции. Каждый класс содержит подклассы, а фермент описывается совокупностью четырех чисел, разделенных точками. Например, алкогольдегидрогеназа имеет шифр 1.1.1.1.
Сначала было выделено 6 классов ферментов (рис. 6), но в 2018 г. к ним добавили еще один, так что их стало семь.

Оксидоредуктазы
Катализируют окислительно-восстановительные реакции (перенос электронов). Очень часто кофакторами таких ферментов выступают молекулы, участвующие в переносе электронов, например НАДН, ФАДН2, гемы и железосерные кластеры. Напомним, что кофакторы — небелковые соединения, присоединяющиеся к ферменту и помогающие ему в осуществлении биологической функции.
Примеры: дегидрогеназы, оксидазы, редуктазы, пероксидазы, каталазы, оксигеназы, гидроксилазы.
Трансферазы
Катализируют перенос химических групп с одной молекулы субстрата на другую. В качестве кофакторов используют кофермент А, пиридоксаль и тиаминпирофосфат.
Примеры: киназы (переносят фосфатную группу с АТФ), трансальдолазы и транскетолазы (вовлечены в цикл Кальвина), ацил-, метил-, гликозил-, фосфорилтрансферазы, трансаминазы.
Гидролазы
Катализируют гидролиз химических связей, то есть расщепление с добавлением к ним молекулы воды.
Примеры: амилаза (гидролизует крахмал), протеазы (гидролизуют белки), в том числе пепсин, трипсин, лизоцим.
Лиазы
Катализируют разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов, а также обратные реакции.
Примеры: декарбоксилазы, альдолазы.
Изомеразы
Катализируют структурные или геометрические изменения в молекуле субстрата (делают изомеры).
Примеры: топоизомеразы, рацемазы, мутазы.
Лигазы (синтетазы)
Катализируют образование химических связей за счёт реакций, сопряжённых с гидролизом АТФ.
Примеры: лигаза, карбоксилаза.
Транслоказы
Катализируют перемещение субстрата с одной стороны на другую.
Примеры: АТФ-синтазы, АВС-транспортеры.
Таким образом, в данной статье мы поближе познакомились с ферментами и углубили свои знания об их свойствах, взаимодействии с субстратом и классификации.
Источники:
- Кокс М., Нельсон Д. Основы биохимии Ленинджера. Том 1. Основы биохимии, строение и катализ. Лаборатория знаний, 2022.
- Webb, E. C. Enzyme nomenclature 1992: recommendations of the Nomenclature Committee of the International Union of Biochemistry and Molecular Biology on the nomenclature and classification of enzymes. Academic Press, 1992.
- Веб-сайт Enzyme Database.
Рекомендуемые материалы:
- Кокс М., Нельсон Д. Основы биохимии Ленинджера. Том 1. Основы биохимии, строение и катализ. Лаборатория знаний, 2022.
- Reece L., Urry L. A., Wasserman S. A., Minorsky P. V., Cain M. L. Campbell Biology (11th Revised 2. Edition), Chapter 9. Pearson, 2014.