Авторы: Денис Лисицкий, студент бакалавриата биологического факультета МГУ им. М.В. Ломоносова, преподаватель кафедры биологии АПО; Иван Смирнов, PhD-1 Life Sciences in Skoltech
История открытия
Как и многие великие открытия, антибиотики стали известны по воле случая. В конце 20-х годов прошлого века британский микробиолог Александр Флеминг изучал культуры стафилококков. Однако, как это обычно случается при несоблюдении стерильности, культура в чашке Петри заросла плесневыми грибами. Флеминг обратил внимание на то, что колонии бактерий вокруг таких нежданных гостей были уничтожены. Это могло говорить лишь о том, что плесень выделяет в среду соединения, смертельные для бактериальных колоний. Так как плесень относилась к роду Penicillium (рис. 1), само активное вещество получило название пенициллин. Флеминг показал его эффективность против возбудителей скарлатины, пневмонии, дифтерии и некоторых других опасных заболеваний. Однако поначалу пенициллин использовался в форме экстракта из пеницилла, что было неэффективно для лечения заболеваний, и лишь спустя десятилетие был выделен в чистом виде.
В СССР также создавались и выпускались антибиотики. Так, в 1942 году З.В. Ермольева и Т.И. Балезина выделили из другого вида пеницилла крустозин — по сути своей пенициллин. В том же году из бактерии Bacillus brevis был выделен новый антибиотик, уже пептидный (состоящий из аминокислот), — грамицидин С. Использование недавно открытых антибиотиков позволило сохранить сотни тысяч жизней раненых во время Второй мировой войны.
В дальнейшем из других микроорганизмов были выделены антибиотики, относящиеся к иным классам соединений. На данный момент известно порядка десятка тысяч различных антимикробных препаратов, при этом поиски продолжаются и по сей день. Что же из себя представляют известные на данный момент антибиотики? Рассмотрим их подробнее в следующем разделе.
Классификация и механизмы действия
Антибиотики — продукты жизнедеятельности клеток, обладающие сравнительно низкой молекулярной массой и подавляющие метаболические процессы у других организмов. Зачем же бактериям и грибам проявлять токсичное поведение и убивать всех вокруг? Все просто: в микробиологических сообществах существует очень жесткая конкуренция за пищевые ресурсы. Поэтому очень удобно просто отравить своих соперников и пировать, не делясь больше ни с кем.
Однако антибиотики — сборная группа любых таких веществ. Они объединяются лишь вследствие своей антибактериальной активности, но кардинально различаются по своей структуре и механизмам действия. Мишенями антибиотиков могут быть структура клеточной мембраны и бактериальные системы реализации и воспроизведения генетической информации (репликация, транскрипция и трансляция), синтеза клеточной стенки. Выделим основные их классы для дальнейшего рассмотрения:
- Бета-лактамные антибиотики (пенициллины, цефалоспорины)
- Циклосерин
- Пептидные антибиотики (грамицидин)
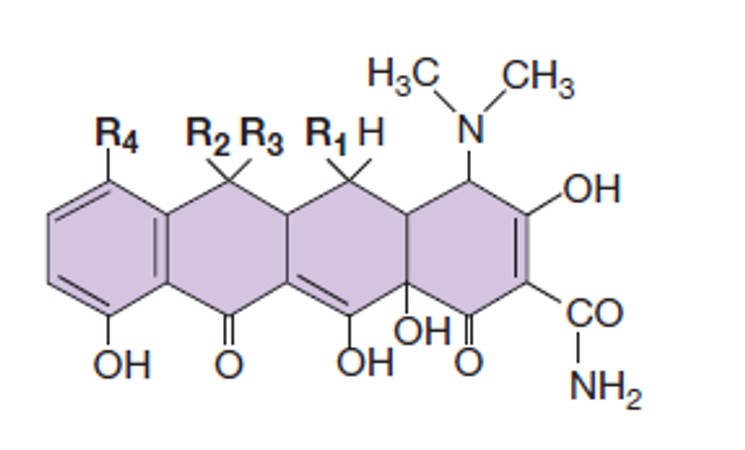
- Тетрациклины
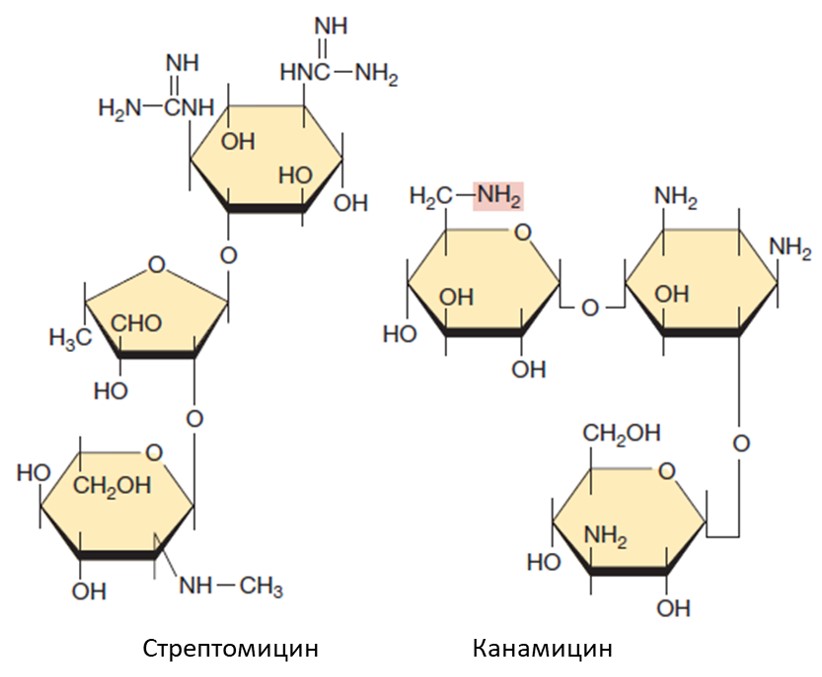
- Аминогликозидные антибиотики (стрептомицин, канамицин)
- Пуриновые антибиотики (пуромицин)
- Линкозамиды (линкомицин)
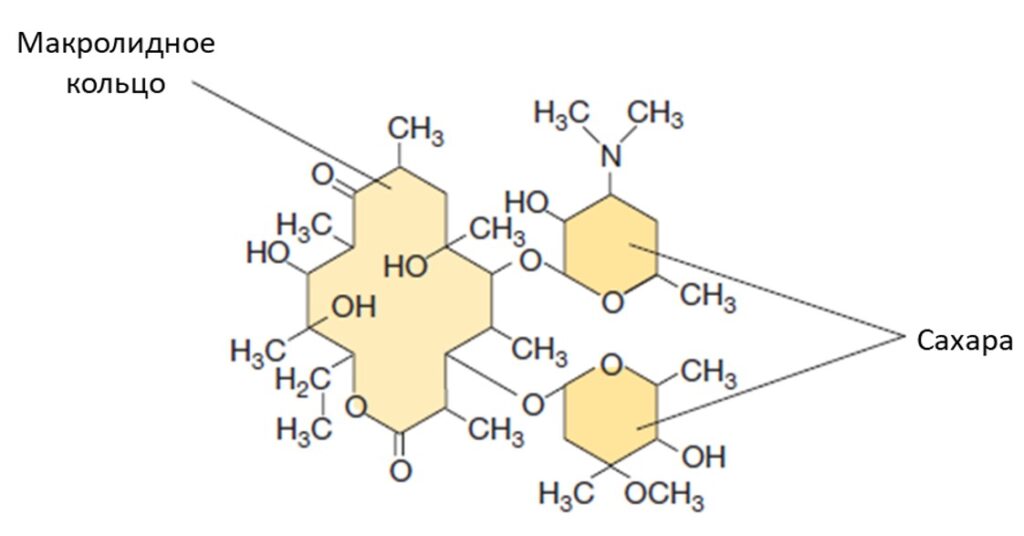
- Макролиды (эритромицин)
- Хлорамфеникол
- Ансамицины (рифамицин)
- Фторхинолоны (офлоксацин)
Неискушенного читателя такое обилие групп может слегка напугать. Но ничего страшного в этом нет, так как мы сгруппируем их по механизму антибактериального действия! А начнем с покровов бактериальной клетки.
Антибиотики, нарушающие синтез клеточной стенки
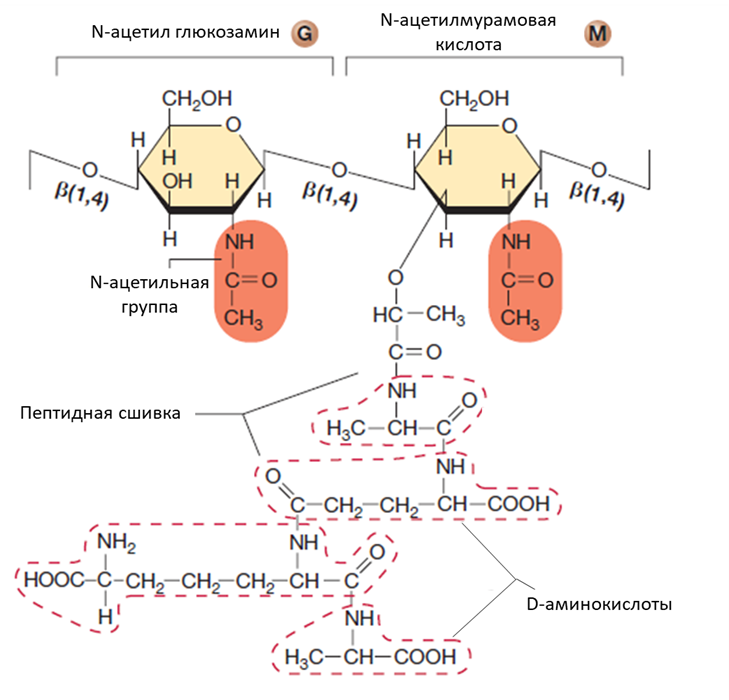
Для начала вспомним, что из себя представляет клеточная стенка бактерий. Это особая покровная структура, обеспечивающая форму бактериальной клетки и ее устойчивость к водному стрессу. Она состоит из особого и весьма необычного материала — пептидогликана, — более известного как муреин. Представляет он собой цепочки полисахарида, сшитые между собой пептидными мостиками из аминокислот. Цепочки состоят из двух чередующихся сахаров — N-ацетилглюкозамина и N-ацетилмурамовой кислоты. К последней присоединен небольшой пептид из нескольких аминокислот (рис. 2). Интересно, что в его состав входят не только широко распространенные протеиногенные L-аминокислоты, но и их изомеры — D-аминокислоты. Они отличаются лишь пространственной структурой, но при этом обычно в состав белков не включаются. Часто полисахаридные цепи сшиваются не только этими небольшими пептидами — у грамположительных бактерий встречаются мостики из пяти глицинов, объединяющие линейные структуры в достаточно прочную цепь (рис. 3).
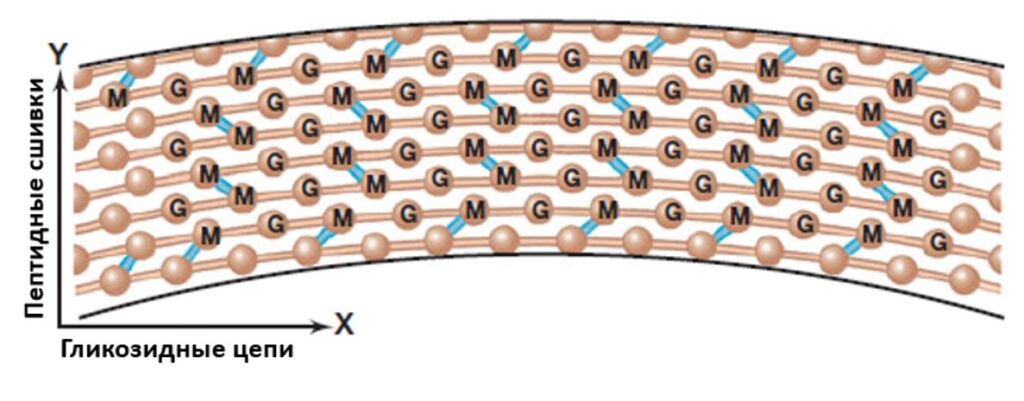
По типу организации клеточной стенки бактерии делятся на две морфологические группы (отнесение бактерий к одной группе не означает их родство): грамположительные и грамотрицательные. Эти названия связаны с фамилией датского микробиолога Ганса Грама, предложившего метод окрашивания микробных клеток. Для грамположительных бактерий характерна только одна клеточная мембрана, которую покрывает толстый слой муреина. К ним относятся, например, золотистый стафилококк, возбудители столбняка и сибирской язвы. Грамотрицательные, в свою очередь, имеют две мембраны и один тонкий слой клеточной стенки между ними. Эта группа включает возбудителя чумы, всем известную кишечную палочку и т. д.
Теперь, освежив в памяти структуру бактериальной клеточной стенки, рассмотрим способы ее нарушить (и тем самым убить бактерию). Первый открытый антибиотик — бензилпенициллин — относится к так называемым бета-лактамным антибиотикам, названным так благодаря бета-лактамному кольцу в своей структуре. Это небольшое соединение продуцируется плесневыми грибами из рода Penicillium и воздействует на фермент, обеспечивающий синтез аминокислотных сшивок, — транспептидазу. Пенициллин, как и любой другой бета-лактамный антибиотик, ковалентно связывается с его активным центром, тем самым ингибируя его активность (рис. 4). В результате клеточная стенка не синтезируется должным образом, что приводит к гибели клетки. Пенициллин и его производные эффективны против обоих типов организации клеточной стенки, прежде всего страдают грамположительные бактерии.
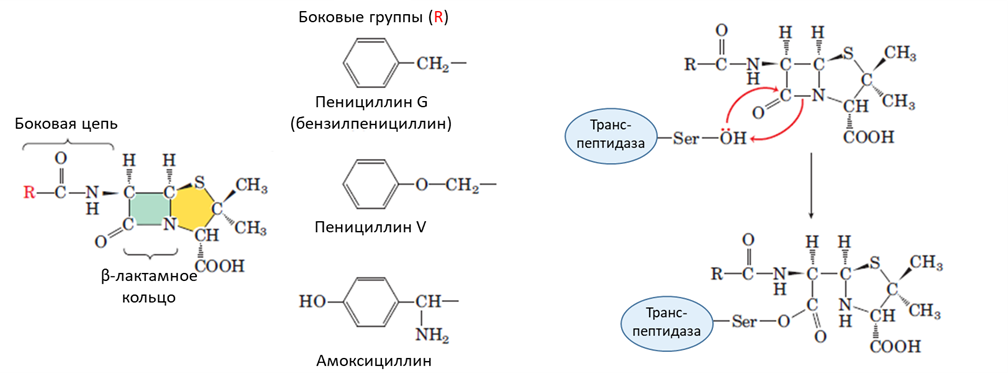
Казалось бы, многие заболевания, вызываемые бактериями, должны были быть искоренены с открытием упомянутого в начале статьи Флеминга. Но все не так просто, и здесь мы впервые коснемся проблемы лекарственной устойчивости. Использование пенициллина послужило фактором отбора бактериальных штаммов, способных противостоять его действию. Они синтезируют фермент бета-лактамазу, который расщепляет циклическую структуру антибиотика, тем самым инактивируя его. Впоследствии ген этого фермента широко распространился в бактериальных сообществах, что сделало бензилпенициллин малоэффективным к настоящему времени. Это не положило конец использованию бета-лактамных антибиотиков, так как был найден ингибитор и на саму бета-лактамазу — клавулановая кислота. При приеме пенициллина и его производных вместе с ней вновь проявлялись антибактериальные эффекты. К настоящему времени распространение получил препарат амоксиклав (амоксициллин + клавуланат), содержащий пару из антибиотика и его «телохранителя».
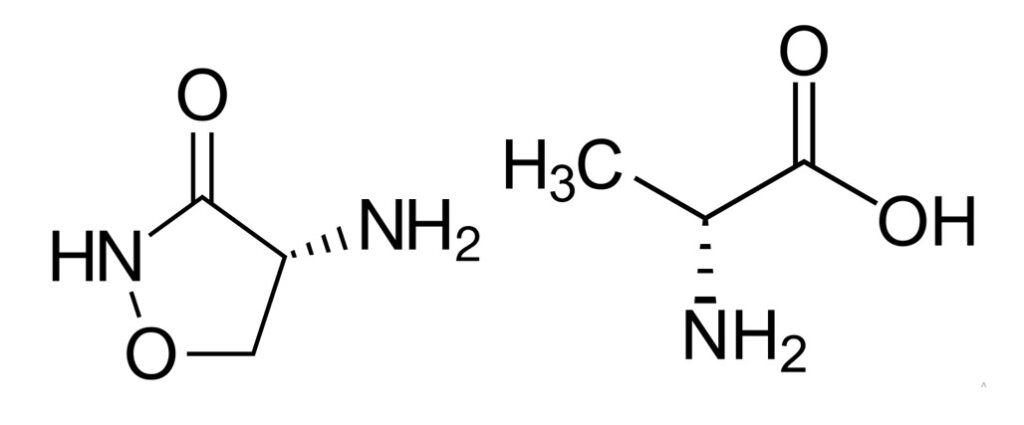
Кроме того, продолжился поиск новых антибиотиков. Были найдены похожие по структуре цефалоспорины и карбапенемы, которые имеют высокую устойчивость к разрушению бета-лактамазой. Еще один антибиотик, нарушающий синтез клеточной стенки бактерий, — циклосерин. Он был выделен из актиномицета (мицелиальной бактерии, внешне похожей на гифы гриба) Streptomyces orchidaceus. Структурно он похож на одну из D-аминокислот, входящих в состав пептидогликана, — D-аланин (рис. 5). Встраиваясь в активный центр фермента, синтезирующего эту аминокислоту, циклосерин ингибирует синтез пептидных сшивок, что приводит к гибели клетки.
Теперь двинемся дальше и рассмотрим способы воздействия на мембрану клетки.
Антибиотики, нарушающие структуру мембраны
Клеточная мембрана состоит из липидного бислоя, состоящего из фосфолипидов. Мембрана не несет на себе функции механической защиты, однако отграничивает внутреннюю среду клетки, обеспечивая ее постоянство. В цитоплазме концентрация различных веществ и ионов отличается от таковой во внешней среде, если нарушить это распределение — клетка неизбежно погибнет. На этом основано действие некоторых пептидных антибиотиков, таких как грамицидин.
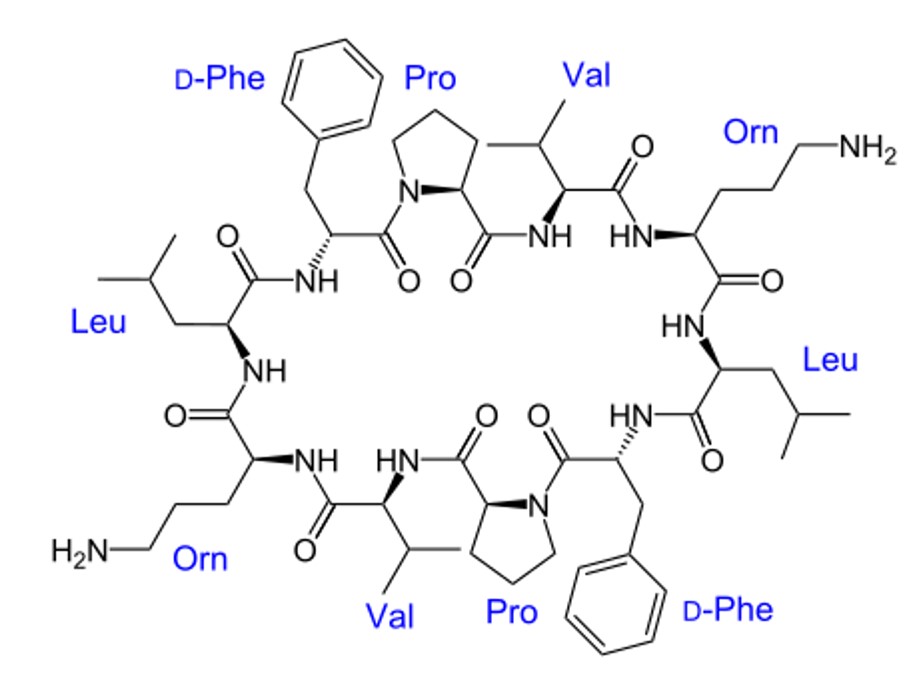
Грамицидин С — циклический пептид, включающий в свой состав необычные аминокислоты — D-фенилаланин и орнитин, не встречающиеся в обычных пептидах и белках (рис. 6). Этот антибиотик был выделен из бактерии Bacillus brevis, эффективен в основном против грамположительных бактерий. Встраиваясь в мембрану, две молекулы грамицидина образуют сквозной канал в ней, что позволяет различным соединениям свободно входить в клетку и выходить из нее.
Мы рассмотрели препараты, воздействующие на клеточные покровы. Но самое интересное скрыто в цитоплазме бактерий, ведь подавляющее большинство антибиотиков воздействуют на бактериальную систему синтеза белка.
Препараты, воздействующие на систему синтеза белка
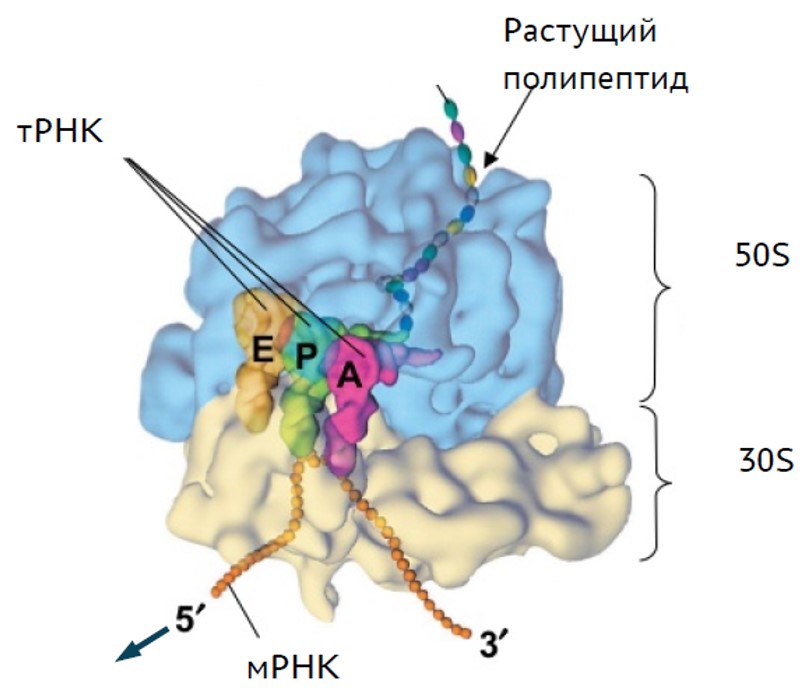
Синтез белка на матрице РНК происходит при помощи специальной молекулярной машины — рибосомы. Чтобы понимать механизм действия многих антибиотиков, необходимо рассмотреть устройство этого комплекса. Прокариотическая рибосома состоит из двух субъединиц — большой (50S) и малой (30S), включающих в себя молекулы рибосомальной РНК и множество белков. Внутри большой субъединицы имеется три сайта связывания транспортной РНК: A-, P- и Е-сайты (рис. 7). Эти «полости» имеют важное значение в элонгации транскрипции — движении рибосомы по матричной РНК и синтезе полипептида.
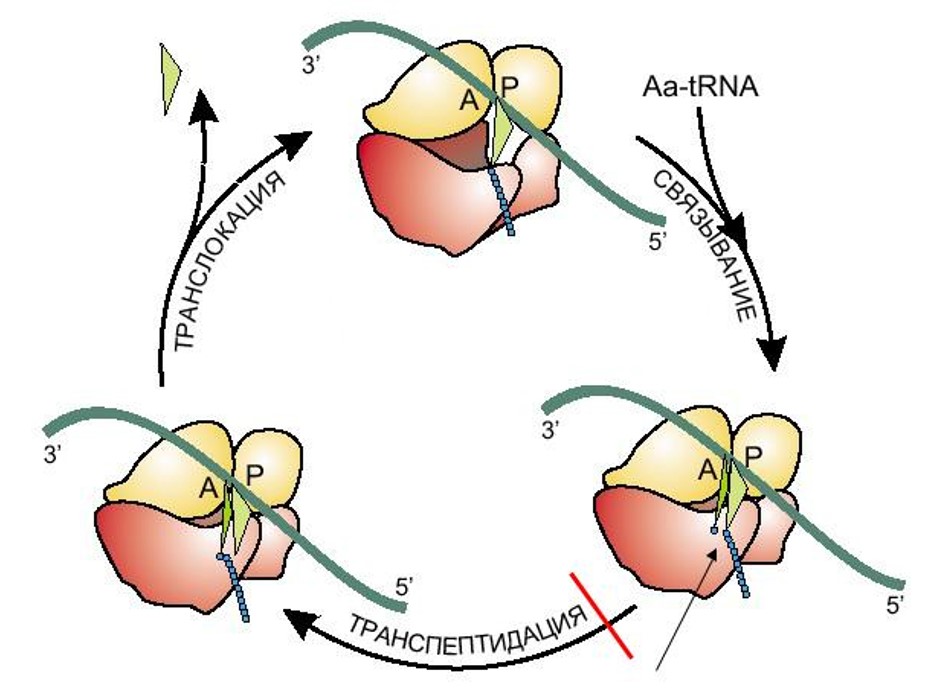
Элонгационный цикл включает в себя несколько стадий (рис. 8):
- В начале занят лишь Р-сайт, в котором расположена пептидил-тРНК — транспортная РНК, связанная с растущим полипептидом. В А-сайт встраивается аминоацил-тРНК, несущая новую аминокислоту.
- Конформация рибосомы изменяется таким образом, что пептид переносится с пептидил-тРНК на аминоацил-тРНК, происходит его удлинение на одну аминокислоту — так происходит транспептидация.
- Рибосома сдвигается на три азотистых основания (триплет) вдоль мРНК, освободившаяся тРНК оказывается в Е-сайте, а новая пептидил-тРНК — в Р-сайте, после чего первая покидает рибосому и цикл начинается заново.
Нарушить синтез белка можно на любой из этих стадий, на каждую из которых нацелены разные группы антибиотиков:
- Тетрациклин, как становится ясно из названия, включает в свою структуру четыре углеводородных цикла (рис. 9). Он занимает А-сайт рибосомы и препятствует связыванию аминоацил-тРНК, без чего элонгационный цикл не начинается.
- Аминогликозидные антибиотики (стрептомицин, канамицин, неомицин) представляют собой небольшие цепочки из трех сахаров с большим количеством аминогрупп (рис. 10). Они также встраиваются в районе А-сайта, наоборот, повышая сродство к любой аминоацил-тРНК, в том числе и к неправильной. Таким образом, в состав полипептида встраиваются случайные аминокислоты, и вследствие этого клетки погибают от большого количества ошибок в белках. Однако действуют эти антибиотики только на аэробные микроорганизмы, так как для их активности необходим кислород. Кроме того, эти антибиотики являются токсичными и вызывают нарушения слуха при длительном приеме. Тем не менее стрептомицин был первым антибиотиком, эффективным против туберкулеза.
- Пуромицин по своей структуре похож на конец тРНК, к которому прикреплена аминокислота. Из-за такой схожести рибосома «путает» его с настоящей аминоацил-тРНК и переносит на него растущий полипептид. Как следствие — синтез обрывается, клетка погибает от недостатка функционирующих белков.
- Линкозамиды (линкомицин) активны в основном против грамположительных бактерий. Они связывают одну из рибосомальных РНК и вызывают преждевременное освобождение пептидил-тРНК из рибосомы, из-за чего белок не успевает синтезироваться до конца.
- Макролиды характеризуются большой кольцевой структурой (рис. 11), первый представитель — эритромицин — был выделен из бактерии Streptomyces erythreus. Эти антибиотики блокируют выход пептида из рибосомы, что тормозит процесс синтеза белка.
Однако есть антибиотики, затрагивающие более ранние стадии реализации генетической информации. Рифамицин образует комплекс с ферментом, синтезирующим РНК, РНК-полимеразой, подавляя ее активность. Фторхинолоны ингибируют важные ферменты, участвующие в репликации ДНК, что приводит к нарушению ее синтеза и невозможности деления бактериальной клетки.
Теперь нам известны основные механизмы воздействия антибиотиков на бактериальные клетки. Все эти пути кажутся достаточно эффективными для того, чтобы раз и навсегда избавить человечество от сотен смертельно опасных заболеваний. Однако дивный новый мир не наступил, так как у многих из них возникла…
Резистентность к антибиотикам
Стоит понимать, что устойчивость к отдельным типам антибиотиков не возникла у бактерий с нуля в ответ на использование их человеком. Микроорганизмы миллиарды лет просуществовали бок о бок с продуцентами антибактериальных соединений, так что многие из них эволюционно выработали механизмы защиты от таких убийственных компонентов среды. Однако массовое использование антибиотиков привело к отбору в пользу микроорганизмов, обладающих такими механизмами. К тому же способность противостоять таким веществам может передаваться за счет так называемого горизонтального переноса генов.
Геном бактерий, помимо большой кольцевой молекулы ДНК, содержит множество плазмид — молекул ДНК поменьше, содержащих определенные гены. Формирование резистентности обусловлено приобретением новой генетической информации за счет передачи R-плазмид (от англ. resistance — устойчивость), которые содержат гены, определяющие устойчивость к одному или нескольким антимикробным препаратам. Плазмиды легко передаются даже микроорганизмам разных видов. Эффективность их передачи лежит в основе эпидемического распространения резистентности в условиях лечебного учреждения, что приводит к полирезистентным внутрибольничным инфекциям (яркий пример — полирезистентный золотистый стафилококк, одна из главных причин внутрибольничных инфекций).
Механизмы резистентности у бактерий различны. Один из них мы рассмотрели во время знакомства с пенициллином: в бактериальной популяции распространился фермент, способный уничтожать молекулы антибиотика. Но это не единственный путь обороны — часто бактерии просто «выкачивают» препарат из клетки за счет специальных мембранных белков-переносчиков. Как следствие — антибиотик не разрушается, но и добраться до своей цели не может.
Нерациональное и необоснованное назначение антибиотиков может инициироваться самими пациентами, когда они применяют антибиотики самостоятельно, без предшествующей врачебной консультации. Пациенты нередко занимаются самолечением антибиотиками при состояниях, не требующих их применения, при этом не принимая весь курс лекарственного препарата. Это приводит к тому, что отсеивается большинство нерезистентных клеток, но среди оставшихся начинают распространяться гены резистентности.
В заключение следует сказать, что знания о действии антибиотиков и их многообразии является важным для любого человека, а образование в этой области способно, может быть, не предотвратить, но хотя бы приостановить распространение антибиотикорезистентности.
Будьте ответственными и учите биологию!
Источники:
- Нетрусов А.И. Микробиология: теория и практика. В 2 ч. Юрайт, 2018.
- Антибиотики и противоинфекционный иммунитет / Под ред. Н.Д. Ющука, И.П. Балмасовой, В.Н. Царева. М.: Практическая Медицина, 2012.
- Современная микробиология. Прокариоты / Под ред. Й. Ленгелера, Г. Древса, Г. Шлегеля. Мир, 2014.
- Madigan M., Bender K., Buckley D., Sattley W., Stahl D. Brock biology of microorganisms. Benjamin Cummings; 13th edition, 2010.
Рекомендуемые материалы:
- Нетрусов А.И. Микробиология: теория и практика. В 2 ч. Юрайт, 2018.
- Потапова Н. Антибиотики и антибиотикорезистентность: от древности до наших дней (доступ на веб-сайте «Биомолекула».
- Антибиотики и противоинфекционный иммунитет / Под ред. Н.Д. Ющука, И.П. Балмасовой, В.Н. Царева. М.: Практическая Медицина, 2012.
- Современная микробиология. Прокариоты / Под ред. Й. Ленгелера, Г. Древса, Г. Шлегеля. Мир, 2014.
- Madigan M., Bender K., Buckley D., Sattley W., Stahl D. Brock biology of microorganisms. Benjamin Cummings; 13th edition, 2010.